
Im vergangenen Jahr ging der Nobelpreis Chemie an Benjamin List und David MacMillan für ihre „Entwicklung der asymmetrischen Organokatalyse”.
Diese grundlegende wissenschaftliche Entdeckung zeigt beispielhaft, wie schnell sich solche „Funde” in der praktischen Anwendung bewähren. Hier geht es um ein chemisches „Werkzeug”, das den Bau besserer, brauchbarer Moleküle unterstützt. Damit steht den Erfindern wieder ein neuer Baukasten zur Verfügung.
Der kann ihnen im Fachgebiet der organisch-chemischen Synthese gute Dienste leisten. Einfacher gesagt: bei der Konstruktion neuer Moleküle, die aus Skeletten und/oder Ringen bestehen. Die Moleküle sind hauptsächlich aus Kohlenstoff und Wasserstoff aufgebaut. Daneben enthalten sie einen geringen Anteil an Elementen wie Sauerstoff, Stickstoff, Fluor, Chlor und Schwefel. Überall in unserer Umgebung sind organisch-chemische Moleküle zu finden, zum Beispiel in Kosmetika, Farbstoffen und Coatings. Die Arzneimittelentwicklung benötigt ständig neue, meist komplexe organisch-chemische Moleküle. Aber sie kommen auch in der modernen Elektronik zur Anwendung. Dort erscheinen sie in organischen Leuchtdioden für Bildschirme oder organischen Speicherzellen in Smartcards.
Synthese heißt erschaffen
Die Synthese organischer Moleküle ist eine Domäne für kreative Bastler. Es gilt, die „richtige” Reihenfolge chemischer Reaktionen (meistens fünf, manchmal über zehn) auszuklügeln. Damit lassen sich Bestandteile eines Moleküls bauen, zusammensetzen und Seitenketten manipulieren. Hier kommen chemische Werkzeuge zum Einsatz: Reagenzien, Lösungsmittel und die unentbehrlichen Katalysatoren. Diese Stoffe sind selbst kein Bestandteil des Moleküls, beeinflussen jedoch die Reaktionsgeschwindigkeit und/oder Bindungsfähigkeit der einzelnen Elemente.
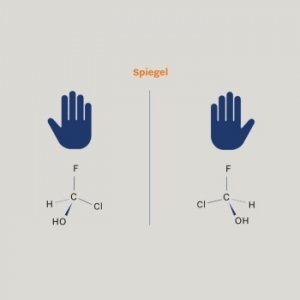
Moleküle im Spiegelbild
Viele organische Moleküle weisen mindestens ein chirales, das heißt asymmetrisches Kohlenstoffatom auf: An jedem Ende ist es an ein anderes Atom oder eine Atomgruppe gebunden. Solche Moleküle kommen durch die Anwesenheit eines asymmetrischen Kohlenstoffatoms in zwei Varianten vor. Beide haben exakt dieselbe Zusammensetzung in exakt derselben Reihenfolge, verhalten sich aber spiegelbildlich zueinander. Wir können dieses Phänomen mit unserer rechten und linken Hand vergleichen. Zweimal dieselbe Handfläche und dieselben Finger in derselben Reihenfolge. Aber unsere Hände passen nur spiegelbildlich genau zusammen. So erklärt sich auch der Begriff Chiralität aus dem altgriechischen Wort für Hand (‘χείρ’). Ein Beispiel aus dem Alltag sind die Enantiomere (Spiegelbilder) der Milchsäure im „links- oder rechtsdrehenden” Joghurt.
Vor allem bei der Arzneimittelherstellung spielt der Bau der richtigen Variante eine maßgebliche Rolle. Denn meist verfügt das eine Enantiomer über die wirksame Eigenschaft und die andere Variante nicht. Eine der Formen kann auch zu unerwünschten Nebenwirkungen führen. Manche erinnern sich gewiss noch an das berüchtigte Schlafmittel Contergan, das in in den 60er Jahren Schwangeren gegen morgendliche Übelkeit verordnet wurde. Bei den Babys dieser Frauen kam es zu schweren Fehlbildungen an den Gliedmaßen. Mit der Verwendung des „guten” Enantiomers hätte dies vermieden werden können.
Organische Moleküle als Reaktionsbeschleuniger
Der oben genannte Vorfall führte zur weiteren Unterscheidung und selektiven Synthese der Enantiomere. Ein durchweg komplizierter Prozess. Chemiker entdeckten bei der selektiven Synthese bereits, dass Katalysatoren die Bildung der unterschiedlichen Enantiomere beeinflussen konnten. 2001 wurde der Chemie-Nobelpreis für die Arbeit mit chiral katalysierten Reaktionen vergeben.
Traditionell kannte man in der organischen Synthese zwei große Gruppen von Katalysatoren: anorganische (auf Metallbasis) und biochemische (auf Enzymbasis). Im Rahmen der nachhaltigen Chemie sollte auf Metall verzichtet werden. Das Problem haben Enzyme nicht, aber da es sich dabei um sehr komplexe Moleküle handelt, die oft schwer zu isolieren und herzustellen sind, sind auch sie nicht ideal geeignet.
Am Anfang dieses Jahrhunderts fanden List und MacMillan unabhängig voneinander eine Lösung des Dilemmas. Sie entdeckten, dass einfache organische Moleküle mit einer geeigneten und zugänglichen Form von Stickstoff gewisse chemische Reaktionen beschleunigen konnten. Damit begründeten sie die Erfolgsgeschichte des neuen Bereiches der Organokatalyse.
Bei der Organokatalyse fügen sich verschiedene Puzzleteile zusammen. Varianten ließen sich einfacher herstellen als mit den gängigen Katalysatoren, weil die neuen Katalysatoren selbst auch organisch-chemische Moleküle sind. Somit boten sich enorme Möglichkeiten für die asymmetrische Katalyse. Dadurch war es möglich, die richtigen Enantiomere für viel mehr verschiedene Moleküle zu synthetisieren. Und durch den Verzicht auf Metalle profiliert sich die asymmetrische Katalyse nun als „grünes”, nachhaltiges chemisches Verfahren.
Spielplatz für Chemiker
Den Experten in der Synthesechemie bietet die Organokatalyse ein reiches Experimentierfeld. Der neue Fachbereich erzeugt neue Katalysatoren und damit neue Stoffe wie Medikamente. Diese Innovationstätigkeit bescherte der neuen Disziplin des 21. Jahrhunderts einen Platz im Patentrecht. Dabei geht es nicht nur um Katalysatoren und Arzneimittel. Auch die Chemiesynthese ist meist ein neuer und erfinderischer Prozess.
Dass die Nobelpreisgewinner List und MacMillan asymmetrischen Organokatalysatoren auf die Spur kamen, besagt noch nicht, dass die Erzeugung eines reinen Enantiomers mit einem organischen Katalysator keine erfinderische Leistung mehr sein kann. Im Gegenteil! Vor allem in einer so „unvorhersehbaren” Wissenschaft wie der Chemie lässt sich im Falle eines komplexen chiralen Moleküls kaum etwas über die Erzeugung der beiden Enantiomere voraussagen. Kreativen Synthesechemikern steht das Tor zu weiteren nützlichen Erfindungen weit offen.
Hajo Kraak erteilt Ihnen gern weitere Auskünfte zu diesem Thema.


